Weltweit leiden mehr als eine Milliarde Menschen an Bluthochdruck und etwa acht Millionen sterben jährlich direkt daran. Die autosomal-dominante Hypertonie mit Brachydaktylie (HTNB, Bluthochdruck mit Kurzfingrigkeit) ähnelt klinisch der essentiellen Hypertonie, also einem Bluthochdruck, dem keine andere Erkrankung zugrunde liegt. Der systolische Blutdruck von HTNB-Patienten reicht von 170 bis 250 mmHg und ihr diastolischer Blutdruck von 100 bis 150 mmHg. Unbehandelt sterben die Patienten vor dem 50. Lebensjahr an einem Schlaganfall.
Mehrere Autoren der neuen Studie hatten zuvor weltweit in sieben nicht verwandten Familien mit HTNB Mutationen im Gen für die Phosphodiesterase (PDE)3A identifiziert. Die Mutationen führen zu einer erhöhten Enzymaktivität; es standen jedoch keine Tiermodelle des genetischen Defekts zur Verfügung, um nachzuweisen, dass PDE3A-Mutationen an HTNB beteiligt sind und ihre Behandlung den Patienten nutzen würde.
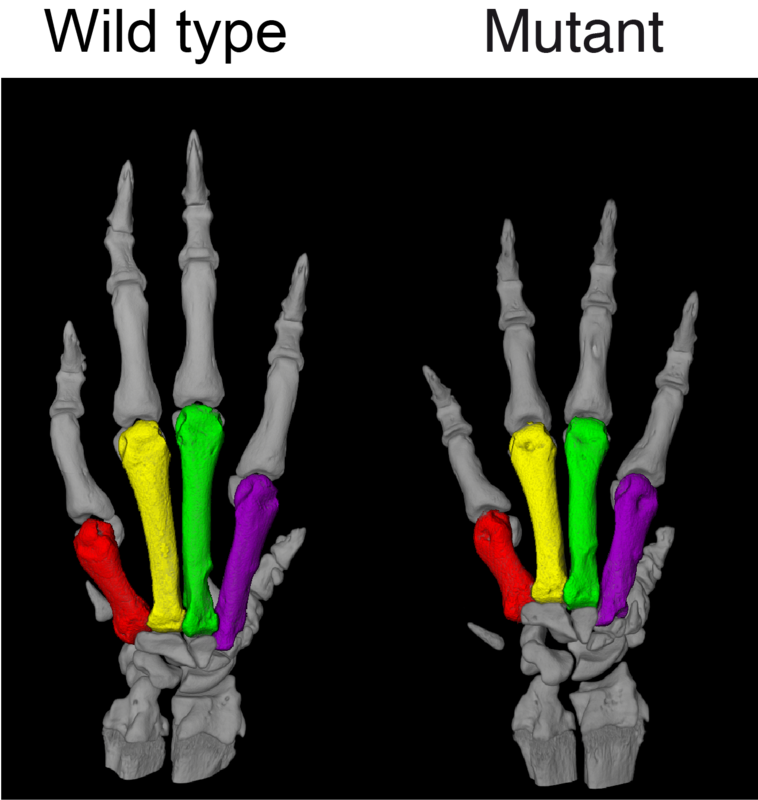
Die Wissenschaftler haben nun eine weitere Mutation im PDE3A-Gen in einer Familie mit HTNB identifiziert. Alle HTNB-Mutationen im PDE3A-Gen lassen sich auf eine 15 bp Hotspot-Region eingrenzen. In einem per CRISPR/Cas9-Technik konstruierten Rattenmodell führte eine 9 bp-Deletion in dieser Region dazu, dass alle menschlichen HTNB-Phänotypen auftraten. Die Überexpression von mutiertem PDE3A in den glatten Gefäßmuskelzellen von Mäusen verursachte ebenfalls eine schwere Hypertonie.
PDE3A hydrolysiert den second messenger cAMP und beendet dadurch das cAMP-Signal. Die PDE3A-Mutante ist überaktiv und beteiligt sich an Protein-Protein-Interaktionen, die sich von denen des Wildtyp-Enzyms unterscheiden. Eine höhere PDE3A-Aktivität könnte den zellulären Signalweg in den Zellen der glatten Gefäßmuskulatur umleiten. Weitere Analysen ergaben, dass der Bluthochdruck bei den Tieren nicht wie beim Menschen durch Störungen des Renin-Angiotensin-Aldosteron-Systems oder des Herzens verursacht wird.
Diese Studie bietet wertvolle Einblicke in die molekularen Mechanismen, die der Hypertonie zugrunde liegen, da sie die Aufmerksamkeit direkt auf den peripheren Gefäßwiderstand lenkt. Die neuen Tiermodelle könnten zu neuen Ansätzen für blutdrucksenkende Behandlungen führen.
*Beitrag zu gleichen Teilen, **Ko-Korrespondent