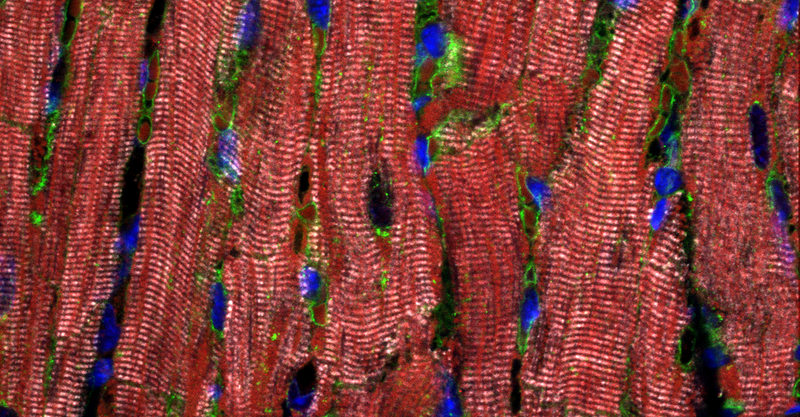
„Die Ursachen von dilatativer Kardiomyopathie sind vielfältig – die häufigste ist allerdings ganz klar eine Mutation, die das Titin-Gen verkürzt“, so Projektleiter Professor Wolfgang Linke, der Direktor des Instituts für Physiologie II der Universität Münster (WWU) ist und eine Arbeitsgruppe am Herzzentrum in Göttingen leitet. Wie die meisten Gene kommt das Titin-Gen zweimal im menschlichen Körper vor. Bei Patienten mit einer dilatativen Kardiomyopathie (DCM) und dieser Mutation ist nur eins der beiden Titin-Gene verkürzt, das andere hat noch seine volle Länge und ist gesund.
„Bislang war es nicht klar, ob Mutationen im Titin-Gen zu einer kürzeren Form des Proteins führen oder dieses verkürzte Protein abgebaut wird“, sagt Professor Norbert Hübner vom Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC). Der DZHK-Forscher war ebenfalls an der Studie beteiligt.
Theoretisch wäre es möglich, dass das gesunde Gen ausreichend Titin produziert, um die Herzmuskelzellen zu versorgen. Anhand von über 100 Herzgewebsproben fand das Forscherteam heraus, dass das gesunde Gen bei den DCM-Patienten zwar verstärkt abgelesen wird, bei ihnen aber trotzdem deutlich weniger gesundes Titinprotein vorkam als bei herzgesunden Menschen oder DCM-Patienten mit einer anderen Krankheitsursache. Weniger Titin bedeutet weniger kontraktile – zum Zusammenziehen fähige – Einheiten im Muskel. Dadurch entwickelt der Muskel weniger Kraft, das Herz ist geschwächt.
Qualitätskontrolle der Zellen versagt
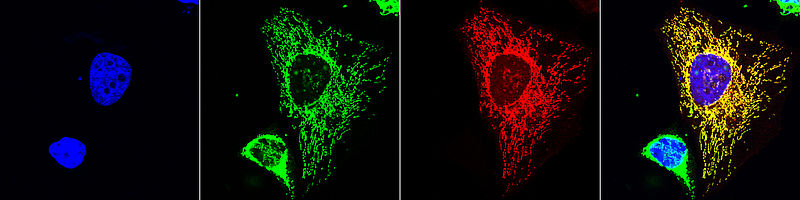
Die Wissenschaftler wiesen darüber hinaus erstmals nach, dass in den Herzmuskelzellen der DCM-Patienten auch verkürzte Titinproteine vorkommen. Bislang hatte man diese verkürzten Proteine nie gefunden. „Wir zeigen, dass die verkürzten Proteine den Herzmuskelzellen nichts mehr nützen, da sie nicht in die Sarkomere, die kleinsten kontraktilen Einheiten einer Muskelzelle, eingebaut werden“, so Linke. Stattdessen sammeln sich die verkürzten Proteine in kleinen Partikeln innerhalb der Zellen. Ähnlich wie bei neurodegenerativen Erkrankungen wie Alzheimer könnten diese verklumpten Proteine laut Linke ‚giftig‘ sein.
Die Herzmuskelzellen von DCM-Patienten mit verkürztem Titin-Gen haben auch ein Problem mit den Protein-Qualitätskontrollsystemen, erkannten die Forscher. Normalerweise werden mutierte Proteine in den Zellen möglichst schnell abgebaut. Die verkürzten Titin-Proteine sind jedoch sehr stabil und werden von den Kontrollsystemen der Zellen nicht erkannt.
Genschere kann Mutation reparieren
„Unsere Studie ist eine für das Feld wegweisende Arbeit“, so Linke. Er und seine Kollegen an der Universitätsmedizin Göttingen und dem Max-Delbrück-Centrum für Molekulare Medizin in Berlin konnten auch vorschlagen, wie DCM-Patienten mit einem verkürzten Titin-Gen erfolgreich behandelt oder sogar geheilt werden könnten. „Wir zeigen an Herzmuskelzellkulturen aus Stammzellen, dass die Genschere CRISP/Cas9 die Mutation wieder reparieren kann. Beim Patienten müsste die Genschere an Ort und Stelle ansetzen, also genau an der Herzmuskelzelle. Das ist in dieser Form noch nicht möglich – aber wenn es möglich wird, kann es die Patienten heilen“, erklärt der Projektleiter.
Die Studie entstand in enger Zusammenarbeit von Institut für Physiologie II und Kardiologie der münsterschen Uniklinik mit dem Herz- und Diabeteszentrum Bad Oeynhausen und der Universitätsmedizin in Göttingen, wo Linke eine Gastprofessur innehat. Weitere Kollaborationspartner sind das Max-Delbrück-Centrum für Molekulare Medizin in Berlin und die Kardiologie an der Technischen Universität München. Unterstützt wurde die Arbeit durch die Deutsche Forschungsgemeinschaft (Sonderforschungsbereich 1002), zwei Förderlinien der Medizinischen Fakultät Münster (IZKF und MedK) und das Deutsche Zentrum für Herz-Kreislaufforschung.
Originalpublikation: Truncated titin proteins and titin haploinsufficiency are targets for functional recovery in human cardiomyopathy due to TTN mutations. Fomin A, Gärtner A, Cyganek L, Tiburcy M, Tuleta I, Wellers L, Folsche L, Hobbach AJ, von Frieling-Salewsky M, Unger A, Hucke A, Koser F, Kassner A, Sielemann K, Streckfuß-Bömeke K, Hasenfuss G, Goedel A, Laugwitz KL, Moretti A, Gummert JF, Dos Remedios CG, Reinecke H, Knöll R, van Heesch S, Hubner N, Zimmermann WH, Milting H, Linke WA. Sci Transl Med. 2021 Nov 3;13(618): eabd3079.
DOI: 10.1126/scitranslmed.abd3079
Quelle: Pressemitteilung der Universität Münster