Michael Potente ist Kardiologe und Blutgefäßforscher. Erst vor wenigen Monaten kam er vom Max-Planck-Institut für Herz- und Lungenforschung an das BIH, wo er nun in seine neuen Labore im gerade eröffneten Käthe-Beutler-Haus in Berlin-Buch einzieht. Dort forscht er am BIH & MDC Center for Vascular Biomedicine. „Auch in diesen bewegten Zeiten haben wir mit Nachdruck an unserem großen Projekt gearbeitet, Blutgefäße besser zu verstehen“, erklärt der Professor für Vaskuläre Biomedizin. „Denn Blutgefäße gibt es überall im Körper, und so spielen sie auch bei vielen Krankheiten eine tragende Rolle.“
Ruhesignale gesucht
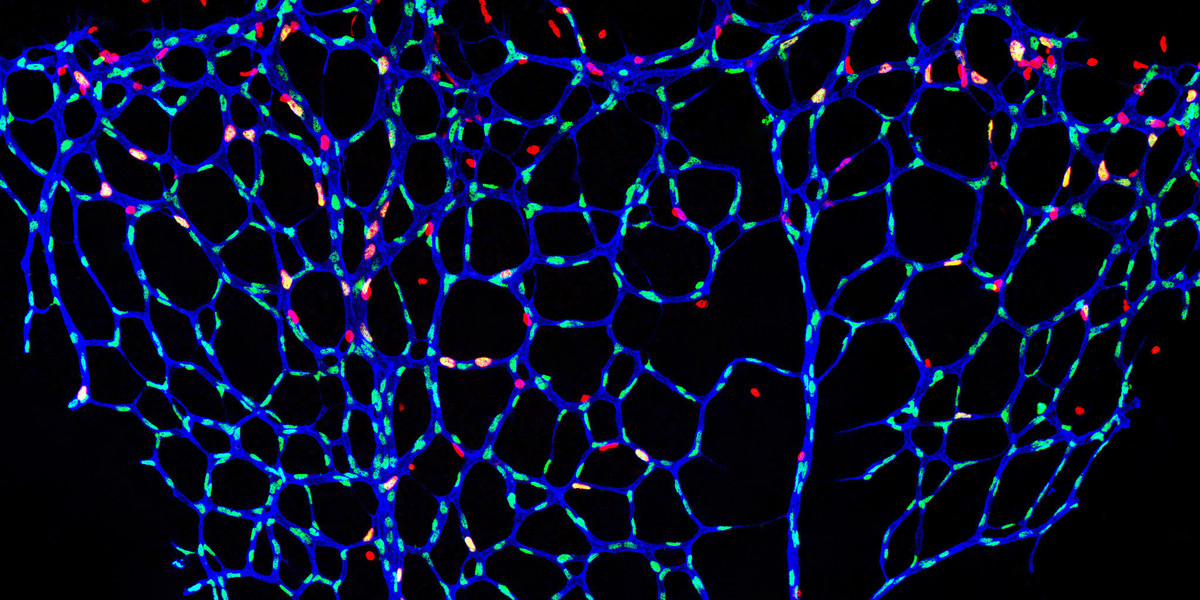
Normalerweise befinden sich Blutgefäße im erwachsenen Körper in einem stabilen Ruhezustand. Neue Gefäßkapillaren sprießen nur selten aus, etwa im Rahmen des weiblichen Zyklus, der Wundheilung oder aber bei krankhaften Prozessen wie dem Tumorwachstum. Die Signale, die die Endothelzellen dann anregen, sich zu teilen, sind zum Großteil bekannt. „Wir wollten jetzt verstehen, was Endothelzellen umgekehrt im Ruhezustand hält – ein Zustand, der auch als Quieszenz bezeichnet wird“, sagt Michael Potente.
Die Wissenschaftler*innen aus seinem Team wussten schon ziemlich genau, wo sie suchen mussten: „Es gibt Faktoren, die die Zelle daran hindern, sich zu vermehren. Ein solcher Faktor ist FOXO1, der das Ablesen von Erbinformation in Zellen steuert: Wenn wir FOXO1 in Endothelzellen ausschalten, führt das zu übermäßigem Gefäßwachstum. Umgekehrt können wir durch gezielte Anschaltung dieses Faktors Blutgefäßbildung stoppen. Wir wollten nun herausfinden, wie genau FOXO1 das macht“, erklärt Jorge Andrade, einer der drei Erstautoren der Veröffentlichung.
S-2-Hydroxyglutarat als „Endothel-Beruhiger“?
Dazu überführten die Wissenschaftler*innen eine dauerhaft aktive Form von FOXO1 in Endothelzellen. Das führte dazu, dass Endothelzellen aufhörten, sich zu teilen und in einem Zustand der Inaktivität verharrten. Um herauszufinden wie FOXO1 das schafft, untersuchten die Forscher*innen den Stoffwechsel (Metabolismus) der Zellen. Hierzu isolierten sie sämtliche Stoffwechselprodukte aus den Zellen, die auch als Metabolite bezeichnet werden. „Dabei haben wir gesehen, das vor allem die Konzentration von 2-Hydoxyglutarat durch FOXO1 anstieg, einem Metaboliten, der in der Krebsmedizin bereits große Bekanntheit erlangt hat“, berichtet Ana Costa, ebenfalls Erstautorin des Papiers. Die Forscher*innen fanden allerdings heraus, dass es sich um eine besondere Form des 2-Hydroxyglutarat handelt: das S-2-Hydroxyglutarat. „Diese Variante unterscheidet sich in Struktur und Funktion von dem in manchen Krebszellen gebildeten Metaboliten“, so Costa.
Um die Rolle von S-2-Hydroxyglutarat als möglichem „Endothel-Beruhiger“ zu bestätigen, führten die Wissenschaftler*innen weitere Experimente in Endothelzellen durch: Sie gaben die Substanz in verschiedenen Konzentrationen und für verschiedene Zeiten zu normalen Endothelzellen. „Dabei haben wir beobachtet, dass allein S-2-Hydroxyglutarat in der Lage ist, Endothelzellen in der Quieszenz zu halten“, erläutert Chenyue Shi, die dritte Erstautorin der Arbeit. Weitere Untersuchungen zeigten, dass das S-2-Hydroxyglutarat seine Wirkung entfaltet, indem es das Ablesen wachstumssteuernder Gene kontrolliert. Auch in Mausmodellen verhinderte das Stoffwechselprodukt das Auswachsen neuer Gefäße, hatte aber auf bereits vorhandene Blutgefäße keine negativen Auswirkungen. Entfernten die Wissenschaftler*innen 2-Hydroxyglutarat wieder, erlangten Endothelzellen ihre Fähigkeit, neue Blutgefäße zu bilden, wieder zurück.
Gezielte Beeinflussung von Blutgefäßen
„Gerade vor dem Hintergrund, dass ein „Zuviel“ oder ein „Zuwenig“ von neuen Blutgefäßen bei vielen Krankheiten eine Rolle spielt, ist es für uns enorm wichtig, die grundlegenden Mechanismen dahinter besser zu verstehen“, fasst Michael Potente die Ergebnisse zusammen. „Unser langfristiges Ziel ist es, das Wachstum und die Funktion von Blutgefäßen gezielt und möglichst ohne Nebenwirkungen therapeutisch beeinflussen zu können. Diesem Ziel sind wir mit der vorliegenden Arbeit ein Stück nähergekommen.“
Originalpublikation: Jorge Andrade, Chenyue Shi, Ana S. H. Costa, Jeongwoon Choi, Jaeryung Kim, Anuradha Doddaballapur, Toshiya Sugino, Yu Ting Ong, Marco Castro, Barbara Zimmermann, Manuel Kaulich, Stefan Guenther, Kerstin Wilhelm, Yoshiaki Kubota, Thomas Braun, Gou Young Koh, Ana Rita Grosso, Christian Frezza & Michael Potente: „Control of endothelial quiescence by
FOXO-regulated metabolites“ Nature Cell Biology 2021 DOI: 10.1038/s41556-021-00637-6
Quelle: Pressemitteilung Berlin Institute of Health (BIH)