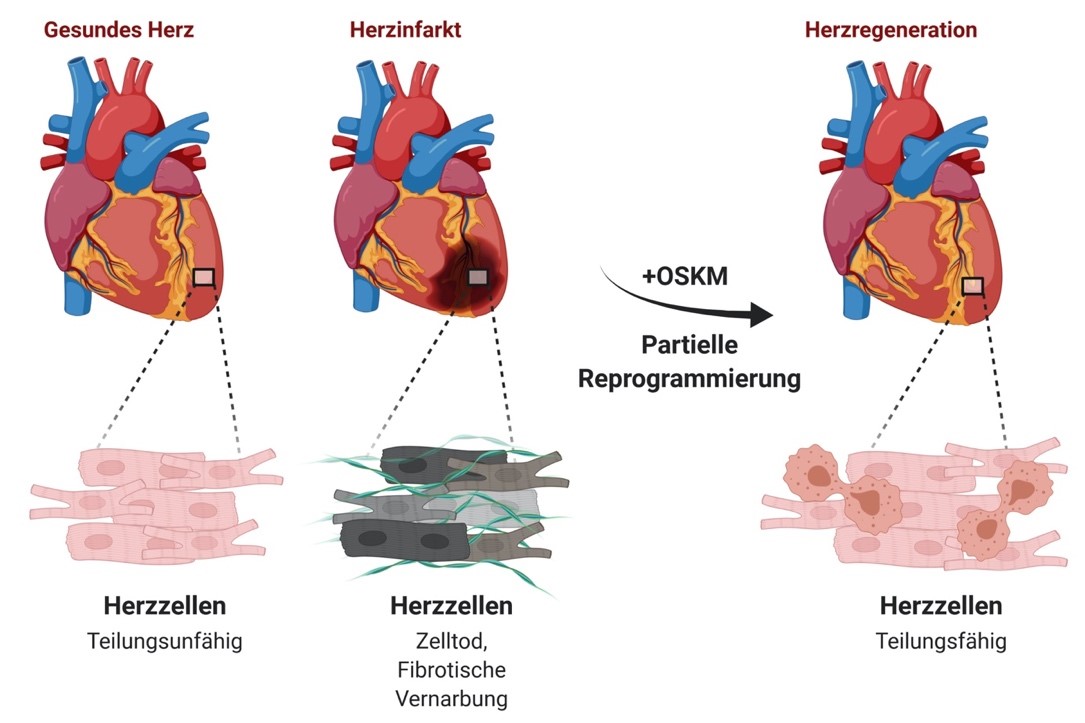
Für ihre Studie setzte das Team um die DZHK-Wissenschaftler Dr. Johnny Kim und Professor Thomas Braun transgene Mäuse ein, bei denen die Expression von vier Stammzellfaktoren im Herz an- und abgeschaltet werden kann. Die künstliche Expression der Faktoren reprogrammiert die Herzmuskelzellen, sodass sie sich zurück entwickeln und wieder teilen können.
Zunächst gelang es den Wissenschaftlern, die Faktoren bei isolierten Herzmuskelzellen der transgenen Mäuse gezielt anzuschalten. Dadurch teilten sich die Zellen allmählich wieder. Auch in den Mäusen waren mit den angeschalteten Faktoren nach sechs Wochen viele Gene aktiv, die an der Zellteilung und Stoffwechselkontrolle beteiligt sind. Wurde die Faktorenexpression wieder abgeschaltet, funktionierte das Herz unverändert. Waren die Faktoren länger aktiv, veränderte sich das Herz jedoch wesentlich und unumkehrbar bis hin zu einer beeinträchtigten Funktion. Bei einer dauerhaften Aktivierung verloren die Herzmuskelzellen sogar ihre ursprüngliche Identität und es bildeten sich Herztumoren.
Balanceakt zwischen Regeneration und Krebsentstehung
Anschließend untersuchten die Forscher, ob die vier Stammzellfaktoren auch Reparaturprozesse am geschädigten Herz auslösen können. „In einem Infarktmodell stellten sich mit kontrolliert eingeschalteter Faktorenexpression Regenerationsprozesse ein. Im Vergleich zu Kontrolltieren war die Infarktnarbe deutlich kleiner“, sagte Kim. Auch die Herzleistung verbesserte sich, wenn die Expression der Faktoren vor oder kurz nach einem Herzinfarkt kurzzeitig eingeschaltet wurde.
Nach Auffassung von Braun, Direktor am Max-Planck-Institut, demonstriert die Studie, dass die therapeutische Wiederherstellung von Organfunktionen in Geweben mit geringer Regenerationsfähigkeit erfolgreich sein kann, wenn teilungsunfähige Zellen ihre Teilungsfähigkeit zurückgegeben wird. „Die Tatsache, dass wir unter bestimmten Voraussetzungen Tumorwachstum am Herzen beobachtet haben, zeigt aber auch, dass es bis zur klinischen Anwendung noch ein weiter Weg ist. Unsere Befunde weisen auf einen natürlichen Gegensatz von Regeneration und Krebsentstehung hin. Gut regenerierende Organe mit hoher Zellteilungsrate zeigen ein hohes, schlecht regenerierende wie das Herz ein niedriges Krebsrisiko. Wird therapeutisch die Regenerationsfähigkeit erhöht, steigt auch das Krebsrisiko. Leider ist nichts im Leben umsonst“.
Originalarbeit: Reversible reprogramming of cardiomyocytes to a fetal state drives heart regeneration in mice. Chen Y, Lüttmann FF, Schoger E, Schöler HR, Zelarayán LC, Kim KP, Haigh JJ, Kim J, Braun T. Science. 2021 Sep 24;373(6562):1537-1540. DOI: 10.1126/science.abg5159.
Quelle: Pressemitteilung Max-Planck-Institut für Herz- und Lungenforschung
Diese wissenschaftliche Publikation wurde vom DZHK-Vorstand zum Paper of the Month Oktober 2021 gewählt.
Hintergrundinformation: Warum heilt das Herz so schlecht?
Das Säugerherz ist ein Hochleistungsorgan. Zuverlässig und an den jeweiligen Bedarf angepasst, pumpt es Blut mit einem relativ hohen Druck durch den Körper. Man nimmt an, dass im Laufe der Evolution diese Leistungsfähigkeit dadurch erkauft wurde, dass die Regenerationsfähigkeit des Organs weitestgehend verloren ging.
Der Grund dafür könnte darin liegen, dass die einzelnen Herzmuskelzellen permanent und sehr eng zu einem sogenannten elektrischen Synzytium verbunden sind. Dabei sind die einzelnen Zellen über Zell-Zell-Kontakte miteinander verschaltet, sodass die für die Herzkontraktion notwendige elektrische Erregungsleitung kontrolliert verlaufen kann. Neue, durch Zellteilung hervorgehende Herzmuskelzellen könnten diesen physiologischen Vorgang stören und das Herz außer Takt bringen.
Entsprechend findet man im Herzen, anders als in Organen mit hoher Regenerationsfähigkeit, keine teilungsfähigen, regenerativen Stammzellen. Der Nachteil: Werden Teile des Herzmuskels geschädigt, wie dies beispielsweise bei einem Herzinfarkt der Fall ist, fehlen dem Herzen die Selbstheilungskräfte. Eine funktionelle Regeneration des geschädigten Herzens findet deshalb in der Regel nicht statt.