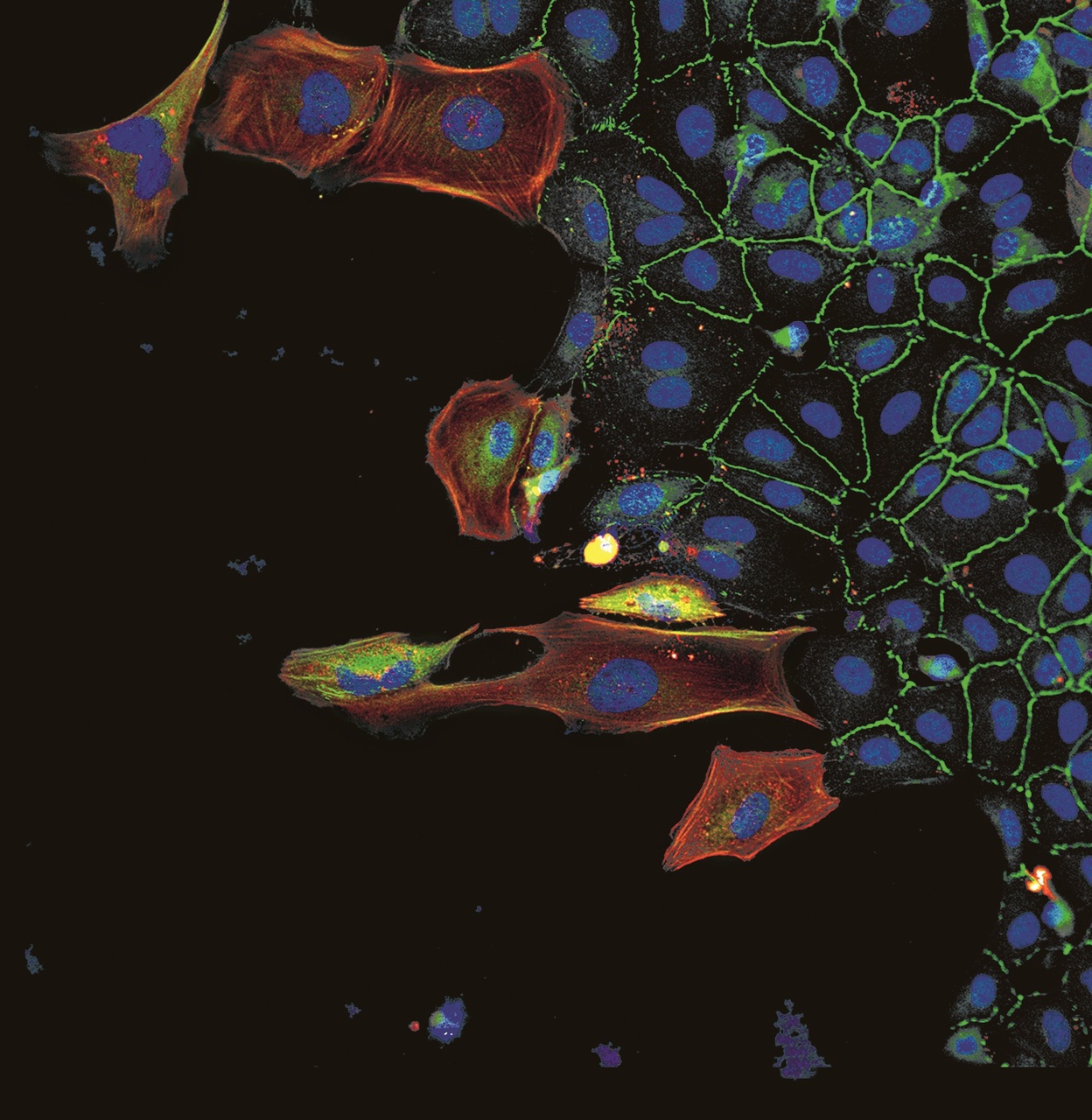
Herz und Gefäße bilden ein hochkomplexes Organsystem, in dem unterschiedlichste Zelltypen reibungslos zusammenarbeiten müssen. Die Endothelzellen, die alle Blutgefäße auskleiden, stabilisieren zusammen mit den Gefäßmuskelzellen die Gefäße und regulieren den Blutdruck. Für das Herzpumpen sind wiederum die Herzmuskelzellen verantwortlich. Was passiert aber in kranken oder altersschwachen Herzen? Das konnten Herzbiologen bisher nur auf der Ebene von Geweben untersuchen. Biologisch relevante Vorgänge, die sich auf der Zellebene abspielen, könnten aber ebenfalls eine Rolle spielen.
Nun gewähren neu entwickelte Verfahren zur Analyse einzelner Zellen erstmals Einblicke in die tatsächliche Vielfalt der Zellen im Herz-Kreislauf-System. Sie erlauben es, gleichzeitig eine Vielzahl an aktiven Genen oder Proteinen in einzelnen Zellen zu analysieren. Um all diese Daten sinnvoll zusammenzuführen und interpretieren zu können, nutzen Forscher Ansätze aus der künstlichen Intelligenz. Maschinenlernverfahren helfen Stefanie Dimmeler und Wesley Aplanalp vom Institut für kardiovaskuläre Regeneration, Zellen mit ähnlichen Eigenschaften zusammenzufassen und nach ihren Eigenschaften und Funktionen zu ordnen.
„Diese Methoden können wir in Krankheitsmodellen anwenden, um erstmals zu untersuchen, wie einzelne Zellen auf Risikofaktoren oder Erkrankungen reagieren“, erklärt Dimmeler. „Wir möchten beispielsweise wissen, ob sich alle Zellen gleichzeitig verändern, oder ob es nur einzelne Zellen oder Zellgruppen sind, die dann Nachbarzellen durch fehlerhafte Kontakte schädigen.“
Von besonderer Bedeutung ist, dass die Einzelzell-Technologie auch auf kleine menschliche Gewebestücke, wie Biopsien, anwendbar ist. Zusammen mit vielen internationalen Forschern trägt Dimmeler die Informationen zusammen, um erstmals einen Atlas des kranken Herzens anfertigen zu können. Erst kürzlich trafen sich Experten aus aller Welt in Frankfurt um gemeinsam über die neuen Technologien und die gewonnenen Erkenntnisse zu diskutieren. Wie umfangreich die Daten sind, die zunächst gesammelt werden müssen, lässt sich durch einen Vergleich mit dem bereits veröffentlichten Zellatlas der gesunden Maus ermessen: Dieser umfasst 100 000 Zellen von 20 Organen und Geweben.
Zur Erstellung des menschlichen Zellatlas wurde im Oktober 2016 in London das Konsortium „Human Cell Atlas“ gegründet. „Bei manchen Zellarten, die beim Menschen in hoher Zahl vorkommen, reicht bereits eine kleine Stichprobe, aber um seltene Zellen wie Stammzellen oder auch komplexe Veränderungen bei Erkrankungen feststellen zu können, müssen sehr viele Zellen analysiert werden“, erklärt Dimmeler. Daher hat die Chan Zuckerberg Initiative von Facebook-Gründer Mark Zuckerberg und seiner Frau, der Kinderärztin Priscilla Chan, das Projekt im Juni 2019 zusätzlich mit 68 Millionen Dollar gefördert.
Die Arbeitsgruppe von Dimmeler arbeitet zusammen mit dem Kardiologen Prof. Andreas Zeiher und dem Herzchirurgen Prof. Thomas Walther daran, die Einzelzellbiologie im kranken und alten Herzen des Menschen aufzuklären. Insbesondere versucht das Team, anhand von menschlichem Blut und kleinen Gewebestückchen, die bei Herzoperationen anfallen, zu verstehen, wie der Herzinfarkt und die dann folgende Narbenbildung die Zusammensetzung und die Kommunikation der Zellen im Herzen verändern. Gibt es möglicherweise seltene, bisher unbekannte Populationen von Stamm- oder Vorläuferzellen? Wie verändern sich die Entzündungszellen im Blut herzkranker Patienten? Und was passiert, wenn die Entzündungszellen ins Herz einwandern?
Während die menschlichen Proben noch gesammelt werden, haben Dimmeler und ihre Mitstreiter an Mäusen bereits festgestellt, dass einzelne Zellpopulationen sich im Alter verändern. Nachfolgende bioinformatische Analysen zeigten zudem eine Veränderung der Gene, die für die Kommunikation der Zellen untereinander verantwortlich sind. „Wir konnten im alten Herzen eine Kommunikationsstörung nachweisen. Im jungen Herzen unterstützen sich die Zellen gegenseitig: Zwischen den Herzmuskel- und Gefäß-bildenden Zellen liegen Zellen des Bindegewebes, sogenannte Fibroblasten. Sie schütten Botenstoffe aus, die die Gefäßzellen positiv beeinflussen. Im Alter werden dagegen andere Botenstoffe gebildet, die zu einer eingeschränkten Durchblutung des Herzens führen könnten“, erklärt die Biologin.
Die Forscher am Cardio-Pulmonary Institute, an dem auch die Universität Gießen und das Max Planck-Institut für Herz- und Lungenforschung beteiligt sind, hoffen, dass die Einzelzelltechnologien künftig dazu beitragen werden, Herz-Kreislauf-Erkrankungen besser zu verstehen. Darauf aufbauend möchten sie neue therapeutische und diagnostische Verfahren entwickeln.
Quelle: Pressemitteilung Goethe-Universität Frankfurt am Main