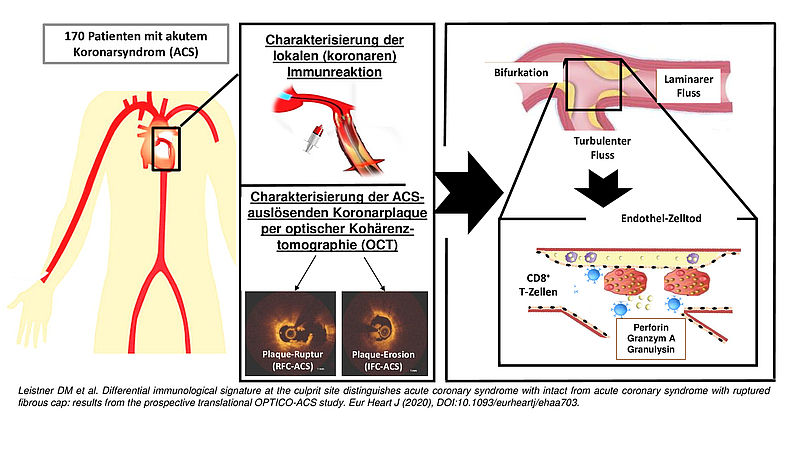
Mit dem neuen Analyseverfahren lässt sich untersuchen, wie Herzmuskelzellen nach einem Herzinfarkt kommunizieren. Dazu wurden Proteine identifziert, die bei einem Herzinfarkt eine Rolle spielen. Für ihre Arbeit erhielten Prof. Dr. Florian Leuschner, Principal Investigator am DZHK, und Tim Christian Kuhn von der Klinik für Kardiologie, Angiologie und Pneumologie des Universitätsklinikums Heidelberg jetzt den Wilhelm P. Winterstein-Preis der Deutschen Herzstiftung. Die Methode, die die beiden Mediziner in Kooperation mit weiteren Forschenden des Universitätsklinikums entwickelt haben, könnte als Grundlage für mögliche therapeutische Ansätze dienen.
Mit Massenspektrometrie die Kommunikation von Herzzellen untersuchen
„Die Forschungsarbeit liefert wichtige Erkenntnisse zu den herzschädigenden Mechanismen bei Herzinfarkt und anderen lebensbedrohlichen kardialen Ereignissen wie Herzschwäche. Damit tragen die Preisträger und ihr Team möglicherweise zur Entwicklung neuer Therapieaspekte bei“, betont der Kardiologe und stellvertretende Vorstandsvorsitzende der Deutschen Herzstiftung, Prof. Dr. Thomas Voigtländer. Das Verfahren der Heidelberger Forscher basiert auf der Massenspektrometrie, eine in der Wissenschaft gängige Methode, mit der man Atome, Moleküle und Proteine analysieren kann. „Bislang war es nicht möglich, die Proteine, die bei der Kommunikation von Herzzellen ausgeschüttet werden, umfassend zu untersuchen“, erklärt der Oberarzt und Heisenberg-Professor Florian Leuschner. „Deswegen haben wir die Massenspektrometrie verfeinert.“ Die Ergebnisse der prämierten Arbeit wurden im Mai dieses Jahres im renommierten Fachjournal „Circulation“ veröffentlicht.
Zellen nach einem Herzinfarkt retten
Die beiden Mediziner nahmen sich Herzzellen vor, die im Stress sind. Das ist zum Beispiel bei einem lebensbedrohlichen Herzinfarkt, den in Deutschland jedes Jahr rund 300.000 Menschen erleiden, der Fall. Die Ursache ist ein verschlossenes Herzkranzgefäß, das die Zellen nicht mehr mit Blut versorgt. Infolgedessen erhalten die Herzmuskelzellen nicht mehr ausreichend Sauerstoff und geraten in Stress. Herzmuskelgewebe stirbt ab, wie viel Gewebe betroffen ist, hängt davon ab, ob ein größeres Blutgefäß oder nur kleinere abgedichtet sind. „Im Zentrum des Infarktgeschehens sterben die Zellen sofort“, sagt Florian Leuschner, der die Experimente geleitet hat. „In weiter entfernten Regionen leiden die Zellen zwar auch an Sauerstoffmangel. Sie sterben jedoch nicht sofort ab. Diese Zellen könnte man noch retten.“ Dieser Aspekt ist wichtig, um Folgeschäden nach einem Herzinfarkt zu minimieren. Im Herzen ersetzen vermehrt Bindegewebszellen, so genannte Fibroblasten, die abgestorbenen Herzzellen. Es entsteht eine Fibrose. Das Herz wird immer steifer und kann schließlich nicht mehr genügend Blut in den Körper pumpen. Eine Herzschwäche kann die Folge sein. „Um hier therapeutisch eingreifen zu können, ist ein genaues Verstehen der zugrundeliegenden Mechanismen von großer Bedeutung“, ergänzt Prof. Dr. Norbert Frey, Ärztlicher Direktor der Klinik für Kardiologie, Angiologie und Pneumologie des Universitätsklinikums Heidelberg.
Schlüsselprotein für Fibrosebildung entdeckt
Bei ihren Untersuchungen setzten die Forscher Herzmuskelzellen aus Tiergewebe in eine so genannte Zellkammer. Das ist eine kleine Box, in der lebende Zellen geschützt unter die Lupe genommen werden können. „In der Kammer erhielten die Zellen aber nur 1,5 Prozent Sauerstoff“, erläutert Assistenzarzt Tim Christian Kuhn das Vorgehen, „also deutlich weniger als unter physiologischen Bedingungen. Das heißt, die Zellen erlitten wie beim Herzinfarkt Sauerstoffmangel und damit Stress.“ Das Ergebnis der Untersuchungen: Die Mediziner fanden 42 Proteine, die von den gestressten Zellen entweder weniger oder verstärkt freigesetzt wurden. Einige davon waren im Zusammenhang mit dem Herzinfarkt bislang völlig unbekannt. „Das sind die für uns interessanten Proteine“, hebt Kuhn hervor. Eines von ihnen ist das „Proprotein convertase subtilisin/kexin type 6“ (PCSK6), dessen Funktion bislang unbekannt war. Die Heidelberger Forscher haben in ihren Experimenten nun entdeckt, dass dieses Eiweiß möglicherweise eine wichtige Rolle bei der Entstehung einer Fibrose im Herzen spielt.
Doppelter Nutzen für Herzpatienten möglich
Diese Ergebnisse lassen sich vermutlich auch auf menschliche Herzzellen übertragen. So zeigte sich im Blut von Patienten nach einem Herzinfarkt vermehrt PCSK6. „Am höchsten war der Level im Blut am dritten Tag nach dem Infarkt“, so Mediziner Kuhn. Patienten könnte PCSK6 nach einem Herzinfarkt in Zukunft doppelt dienen: Erstens, indem man das Protein therapeutisch blockiert und so eine Fibrose und die damit einhergehende Herzschwäche bremst. Zweitens könnte es als Biomarker im Blut anzeigen, dass die Herzzellen nicht genug Sauerstoff bekommen.
Über den Winterstein-Preis
Der Wilhelm P. Winterstein-Preis wird alljährlich für eine wissenschaftlich herausragende Arbeit auf dem Gebiet der Herz-Kreislauf-Erkrankungen, bevorzugt aus einem patientennahen Forschungsbereich, vergeben. 2020 hat die Stifterin Ursula Winterstein den Preis ihres 2018 verstorbenen Ehemannes für das ausgezeichnete Forschungsprojekt der Heidelberger Forscher vergeben. Infos: www.herzstiftung.de/herzstiftung-und-forschung
Originalpublikation: Kuhn, T. C. et al., Secretome Analysis of Cardiomyocytes Identifies PCSK6 as a Novel Player in Cardiac Remodeling After Myocardial Infarction. Circulation, doi:10.1161/CIRCULATIONAHA.119.044914
Quelle: Universitätsklinikum Heidelberg